Ang regulasyon ng synthesis ng kolesterol
Ang regulasyon ng synthesis ng kolesterol - ang key enzyme (HMG-CoA reductase) ay isinasagawa sa iba't ibang paraan.
Phosphorylation / dephosphorylation ng HMG reductase. Sa pamamagitan ng pagtaas ng ratio ng insulin / glucagon, ang enzyme na ito ng phosphory template at pumasa sa isang aktibong estado. Ang pagkilos ng insulin ay isinasagawa sa pamamagitan ng 2 mga enzyme.
Ang HMG-CoA reductase kinase phosphatase, na lumiliko ang kinase sa isang hindi aktibo na estado ng dephosphorylated:
Ang Phosphotase HMG-CoA reductase sa pamamagitan ng pag-convert nito sa isang aktibong estado ng dephosphorylated. Ang resulta ng mga reaksyon na ito ay ang pagbuo ng isang dephosphorylated na aktibong anyo ng HMG-CoA reductase.
Dahil dito, sa panahon ng pagsipsip, tumataas ang kolesterol. Sa panahong ito, ang pagkakaroon ng paunang substrate para sa synthesis ng kolesterol - acetyl - Ang CoA ay nagdaragdag (bilang resulta ng pagkain ng pagkain na naglalaman ng mga karbohidrat at taba, dahil ang CoA acetyl ay nabuo sa panahon ng pagkasira ng glucose at fatty acid).
Sa estado ng postabsorbent, ang glucagon sa pamamagitan ng proteingenase A ay nagpapasigla sa phosphorylation ng HMG - CoA - reductase, na nagiging isang hindi aktibo na estado. Ang pagkilos na ito ay pinahusay ng katotohanan na sa parehong oras ay pinasisigla ng glucagon ang phosphorylation at hindi aktibo ng phosphotase ng HMG-CoA reductase, sa gayon pinapanatili ang redmase ng HMG-CoA sa isang phosphorylated na hindi aktibo na estado. Bilang isang resulta, ang synthesis ng kolesterol sa panahon ng postabsorption at sa panahon ng pag-aayuno ay hinarang ng endogenous synthesis. Kung ang nilalaman ng kolesterol sa pagkain ay dinala sa 2%, kung gayon ang pagbubuo ng endogenous kolesterol ay bumaba nang matindi. Ngunit ang kumpletong pagtigil ng synthesis ng kolesterol ay hindi nangyayari.
Ang antas ng pagsugpo ng biosynthesis ng kolesterol sa ilalim ng impluwensya ng kolesterol na nagmumula sa pagkain ay nag-iiba mula sa bawat tao. Ipinapahiwatig nito ang sariling katangian ng mga proseso ng pagbuo ng kolesterol. Sa pamamagitan ng pagbawas ng intensity ng synthesis ng kolesterol, posible na mabawasan ang konsentrasyon nito sa dugo.
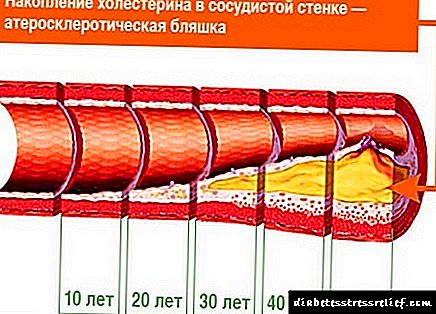
Kung ang balanse sa pagitan ng paggamit ng kolesterol na may pagkain at synthesis nito sa katawan sa isang banda at ang paglabas ng mga acid ng bile at kolesterol sa iba pa ay nasira, ang konsentrasyon ng kolesterol sa mga tisyu at pagbabago ng dugo. Ang pinaka-malubhang kahihinatnan ay nauugnay sa isang pagtaas sa konsentrasyon ng kolesterol sa dugo (hypercholesterolemia), habang ang posibilidad ng pagbuo ng atherosclerosis at cholelithiasis ay nagdaragdag.
Familial hypercholesterolemia (HCS) - ang form na ito ay mas karaniwan - tungkol sa 1 pasyente bawat 200 katao. Ang isang minanang depekto sa HCS ay isang paglabag sa pagsipsip ng LDL ng mga cell, at samakatuwid, isang pagbawas sa rate ng LDL catabolism. Bilang isang resulta, ang konsentrasyon ng LDL sa dugo ay tumataas, pati na rin ang kolesterol dahil marami ito sa LDL. Samakatuwid, sa HCS, pag-aalis ng kolesterol sa mga tisyu, partikular sa balat (xanthomas), sa mga dingding ng mga arterya ay katangian.
Paglikha ng synthesis ng HMG-CoA reductase
Ang pangwakas na produkto ng metabolic pathway ng kolesterol. Binabawasan nito ang rate ng transkripsyon ng HMG-CoA reductase gene, kaya pinipigilan ang sariling synthesis. Ang atay ay aktibong synthesizing bile acid mula sa kolesterol, at samakatuwid ang mga acid ng apdo ay nagbabawas sa aktibidad ng HMG-CoA reductase gene. Dahil ang redmase ng HMG-CoA ay umiiral pagkatapos ng synthesis ng tungkol sa 3, ang pagsugpo sa synthesis ng enzim na kolesterol na ito ay isang mabisang regulasyon.
Hindi nahanap ang iyong hinahanap? Gamitin ang paghahanap:
Palitan ng esterya ng kolesterol
Ang pondo ng kolesterol ay naglalaman ng mga libreng ester ng kolesterol at kolesterol, na matatagpuan sa parehong mga selula at sa mga lipoproteins ng dugo.
Bahagi II. Metabolismo at enerhiya
Sa mga cell, ang esterification ng kolesterol ay nangyayari sa aksyon ng acyl-CoA-cholesterol-acyltransferase (AChAT):
Acyl-CoA + Cholesterol - * HS-KoA + Acylcholesterol
Sa mga cell ng tao, ang linoleylcholesterol ay pangunahing nabuo. Hindi tulad ng libreng kolesterol, ang mga ester nito sa mga membran ng cell ay nakapaloob sa napakaliit na halaga at higit sa lahat ay matatagpuan sa cytosol bilang bahagi ng mga patak ng lipid. Ang pagbuo ng mga ester ay maaaring isaalang-alang, sa isang banda, bilang isang mekanismo para sa pag-alis ng labis na kolesterol sa mga lamad, at sa kabilang banda, bilang isang mekanismo para sa pag-iimbak ng kolesterol sa cell. Ang pagpapakilos ng mapagkukunan ay nangyayari sa pakikilahok ng mga esterase enzymes na nag-hydrolyze ng mga esters ng kolesterol:
Acylcholesterol + H 2O - * Fatty acid + Cholesterol
Ang synthesis at hydrolysis ng mga ester ay nangyayari sa maraming mga cell, ngunit lalo na aktibo sa mga selula ng adrenal cortex: sa mga cell na ito hanggang sa 80% ng lahat ng kolesterol ay kinakatawan ng mga estero, habang sa iba pang mga selula ay karaniwang mas mababa sa 20%.
Ang pagbuo ng mga ester sa liponroteins ng dugo ay nagaganap kasama ang pakikilahok ng lecithin-kolesterol acyltransferase (LHAT), na pinangangalagaan ang paglipat ng nalalabi na acyl mula sa i-posisyon ng lecithin sa kolesterol (Fig. 10.31). Ang rate ng esterification para sa iba't ibang mga lipoprotein ay makabuluhang naiiba at nakasalalay sa pagkakaroon ng mga apolipoproteins na nag-oaktibo sa LHAT (pangunahin ang apo-AT, pati na rin CI) o pagbawalan (C-II) ang enzyme.Ang pinaka-aktibong LHAT sa HDL, kung saan apo-AT kailangang olee 2/3 ng lahat ng mga protina. Ang pinakamalaking coli honors nabuo esters ng oleic at linoleic acids. Ang iba pang mga lipoproteins ester formation ay nangyayari sa isang mas mabagal na tulin kaysa sa HDL.
Fig. 10.31. Ang pagbuo ng mga kolesterol esters sa ilalim ng pagkilos ng LHAT
Ang LHAT ay naisalokal sa layer ng ibabaw ng HDL at gumagamit ng kolesterol sa phospholipid monolayer bilang isang substrate. Ang mga estersang kolesterol na nabuo dito, dahil sa kanilang kumpletong hydrophobicity, ay hindi maayos na pinanatili
Kabanata 10. Metabolismo at Pag-andar ng Lipid
phospholipid monolayer at nalubog sa lipid core ng lipoprotein. Kasabay nito, ang isang lugar para sa kolesterol ay pinalaya sa phospholipid monolayer, na maaaring mapunan ng kolesterol mula sa mga lamad ng cell o mula sa iba pang mga lipoproteins. Sa gayon, ang HDL ay lumilitaw na isang bitag na kolesterol bilang isang resulta ng pagkilos ng LHAT.
Synthesis ng Bile Acid
Sa atay, ang bahagi ng kolesterol ay na-convert sa mga acid ng apdo. Ang mga asidong Gallic ay maaaring isaalang-alang bilang mga derivatives ng cholanic acid (Fig. 10.32).
Ang Cholanic acid tulad nito ay hindi nabuo sa katawan. Sa mga hepatocytes, ang kolesterol ay direktang gumagawa ng chenodeoxycholic at cholic acid - pangunahing mga acid ng apdo (Fig. 10.33, tingnan din ang Fig. 10.12).
Biosynthesis ng kolesterol
Ang biosynthesis ng kolesterol ay nangyayari sa endoplasmic reticulum. Ang mapagkukunan ng lahat ng mga carbon atoms sa molekula ay acetyl-SCoA, na nagmumula dito mula sa mitochondria bilang bahagi ng citrate, tulad ng sa synthesis ng mga fatty acid. Kinokonsumo ng kolesterol biosynthesis ang 18 ATP molekula at 13 NADPH molekula.
Ang pagbuo ng kolesterol ay nangyayari sa higit sa 30 reaksyon, na maaaring maipangkat sa maraming yugto.
1. Sintesis ng mevalonic acid.
Ang unang dalawang reaksiyon ng synthesis ay nag-tutugma sa mga reaksyon ng ketogenesis, ngunit pagkatapos ng synthesis ng 3-hydroxy-3-methylglutaryl-ScoA, pumapasok ang enzyme. hydroxymethyl-glutaryl-ScoA reductase (HMG-SCOA reductase), na bumubuo ng mevalonic acid.
 |
Ang scheme ng reaksyon ng kolesterol synthesis2. Sintesis ng isopentenyl diphosphate. Sa yugtong ito, tatlong residu ng pospeyt ang nakakabit sa mevalonic acid, kung gayon ito ay decarboxylated at dehydrogenated. 3. Matapos ang pagsasama ng tatlong mga molecule ng isopentenyl diphosphate, ang farnesyl diphosphate ay synthesized. 4. Ang synthesis ng squalene ay nangyayari kapag ang dalawang residu ng farnesyl diphosphate ay nakatali. 5. Matapos ang mga kumplikadong reaksyon, ang mga linear squalene ay bumibiyahe sa lanosterol. 6. Ang pagtanggal ng labis na mga grupo ng methyl, pagpapanumbalik at isomerization ng molekula ay humahantong sa hitsura ng kolesterol. Ang regulasyon ng aktibidad ng hydroxymethylglutaryl-S-CoA reductase3. Ang rate ng kolesterol biosynthesis ay nakasalalay din sa konsentrasyon tiyak na protina ng carrierpagbibigay para sa pagbubuklod at transportasyon ng mga hydrophobic intermediate synthesis syntites. Maaari mong hilingin o iwanan ang iyong opinyon. Ang pangunahing punto ng regulasyon ay ang reaksyon ng pagbuo ng mevalonic acid. 1. Lahat ng regulasyon. Ang kolesterol, at sa atay - at mga acid ng bile ay pumipigil sa redmase ng HMG-CoA. 2. Repression ng synthesis ng HMG-CoA reductase kolesterol. 3. Ang regulasyon sa pamamagitan ng phosphorylation-dephosphorylation ng HMG-CoA reductase, aktibong di-phosphorylated form. Ang glucagon ay nagiging sanhi ng pag-deactivation, at ang insulin ay nagiging sanhi ng pag-activate sa pamamagitan ng isang kumplikadong kaskad ng mga reaksyon. Kaya, nagbabago ang rate ng synthesis ng kolesterol na may pagbabago sa mga estado ng pagsisipsip at postabsorption. 4. Ang rate ng synthesis ng HMG-CoA reductase sa atay ay napapailalim sa malinaw na pagbagsak ng pagbagsak: maximum sa hatinggabi, at minimum sa umaga. Palitan ng esterya ng kolesterol Sa mga cell nangyayari ang cholesterol esterification kapag nakalantad acyl-CoA-kolesterol-acyltransferase (AHAT): Acyl-CoA + Cholesterol ® NS-CoA + Acylcholesterol Sa mga cell, higit sa lahat linoleylcholesterol ay nabuo. Ang mga Ester ay matatagpuan higit sa lahat sa cytosol bilang bahagi ng mga patak ng lipid. Ang pagbuo ng mga ester ay maaaring isaalang-alang, sa isang banda, bilang isang mekanismo para sa pag-alis ng labis na kolesterol sa mga lamad, at sa kabilang banda, bilang isang mekanismo para sa pag-iimbak ng kolesterol sa cell. Ang pagpapakilos ng mga reserba ay nangyayari sa pakikilahok ng mga enzymes esterasehydrolyzing kolesterol esters: Acylcholesterol + H2O ® Fatty Acid + Cholesterol Ang synthesis at hydrolysis ng mga ester ay lalo na aktibo sa mga selula ng adrenal cortex. Sa mga lipoproteins ng dugo ang pagbuo ng ester ay nangyayari sa pakikilahok ng lecithin-cholesterol-acyltransferase (LHAT), catalyzing ang paglipat ng residue ng acyl mula sa lecithin hanggang sa kolesterol. Ang LHAT ay nabuo sa atay, na nakatago sa agos ng dugo at nakadikit sa mga lipoproteins. Ang pinaka-aktibong LHAT sa HDL, kung saan ito ay naisalokal sa layer ng ibabaw. Ang mga esters ng kolesterol na nabuo dito ay hydrophobic at nalubog sa lipid core. Sa monolayer ng phospholipid, mayroong libreng puwang para sa kolesterol, na maaaring mapunan ng kolesterol mula sa mga lamad ng cell o mula sa iba pang mga lipoproteins. Sa gayon, ang HDL ay lumilitaw na isang bitag na kolesterol bilang isang resulta ng pagkilos ng LHAT. Synthesis ng Bile Acid Sa atay, ang bahagi ng kolesterol ay na-convert sa mga acid ng apdo. Ang mga acid acid ay maaaring isaalang-alang bilang derivatives ng cholanic acid. Ang Cholanic acid tulad nito ay hindi nabuo sa katawan. Sa mga hepatocytes mula sa kolesterol, nabuo ang pangunahing mga acid ng apdo - chenodeoxycholic at cholic. Matapos ang pagtatago ng apdo sa bituka sa ilalim ng pagkilos ng mga enzymes ng flora ng bituka, ang pangalawang mga acid ng apdo ay nabuo mula sa kanila - lithocholic at deoxycholic. Ang mga ito ay nasisipsip mula sa mga bituka, na may dugo ng portal vein ay pumapasok sa atay, at pagkatapos ay sa apdo. Ang butil ay naglalaman ng pangunahin na conjugated bile acid, i.e., ang kanilang mga compound na may glycine o taurine. Ang konsentrasyon ng mga acid ng apdo sa apdo ay halos 1%. Ang pangunahing bahagi ng mga acid ng apdo ay kasangkot hepatoenteric sirkulasyon.Ang isang maliit na bahagi ng mga acid ng apdo - halos 0.5 g bawat araw - ay pinalabas sa mga feces. Ito ay binabayaran ng synthesis ng mga bagong mga acid ng apdo sa atay, ang pondo ng bile acid ay na-update sa halos 10 araw. Ang kolesterol ay pinalabas din lalo na sa pamamagitan ng mga bituka. Pumasok ito sa mga bituka na may pagkain at mula sa atay bilang bahagi ng apdo. Ang kolesterol na nasisipsip sa dugo ay naglalaman ng isang maliit na bahagi na nagmula sa apdo (endogenous kolesterolsynthesized sa atay), at ang maliit na bahagi na nagmula sa pagkain (exogenous kolesterol) Ang pag-alis ng kolesterol sa mga tisyu ay nangyayari sa pamamagitan ng oksihenasyon nito sa mga acid ng apdo sa atay, na sinusundan ng kanilang pag-aalis ng mga feces (humigit-kumulang na 0.5 g bawat araw) at sa pamamagitan ng pag-aalis ng hindi nagbabago na kolesterol (kasama din ang mga feces). Sa nakatigil na estado: (Kolesterolwakas + Kolesterolex) - (Kolesterolexcre + Mga acid acidexcre) = 0 Kung ang balanse na ito ay nabalisa, ang konsentrasyon ng kolesterol sa mga tisyu at sa dugo ay nagbabago. Tumaas na kolesterol ng dugo - hypercholesterolemia. Pinatataas nito ang posibilidad ng sakit na atherosclerosis at sakit sa bato. LIPID EXCHANGE REGULATION Ang metabolismo ng lipid ay kinokontrol ng gitnang sistema ng nerbiyos. Mahabang pangmatagalang negatibong emosyonal na stress, ang isang pagtaas sa pagpapalabas ng catecholamines sa daloy ng dugo ay maaaring maging sanhi ng kapansin-pansin na pagbaba ng timbang. Pagkilos glucagon sa sistema ng lipolytic ay katulad ng pagkilos ng mga catecholamines. Adrenaline at norepinephrine dagdagan ang aktibidad ng tissue lipase at ang rate ng lipolysis sa adipose tissue, bilang isang resulta, ang nilalaman ng mga fatty acid sa plasma ng dugo ay tumataas. Insulin ay may kabaligtaran na epekto ng adrenaline at glucagon sa lipolysis at pagpapakilos ng mga fatty acid. Paglago ng hormone pinasisigla ang lipolysis, hinihimok ang synthesis ng acenylate cyclase. Ang pituitary hypofunction ay humahantong sa pag-aalis ng taba sa katawan (pituitary obesity). Thyroxine, sex hormonesnakakaapekto rin sa metabolismo ng lipid. Ang pag-alis ng mga glandula ng sex sa mga hayop ay nagiging sanhi ng labis na pag-aalis ng taba. LIPID EXCHANGE DISORDERS Ang Cholesterol ay isang steroid na tiyak sa mga organismo ng hayop. Ang pangunahing lugar ng pagbuo nito sa katawan ng tao ay ang atay, kung saan ang 50% ng kolesterol ay synthesized, ang 15-20% ay nabuo sa maliit na bituka, ang natitira ay synthesized sa balat, adrenal cortex at gonads. Ang mga mapagkukunan ng pagbuo ng pondo ng kolesterol at ang mga paraan ng paggasta nito ay ipinakita sa Fig. 22.1. Fig. 22.1. Ang pagbuo at pamamahagi ng kolesterol sa katawan. Ang kolesterol ng katawan ng tao (kabuuang halaga ng halos 140 g) ay maaaring kondisyon na nahahati sa tatlong pool: 30 g), mabilis na pagpapalitan, ay binubuo ng kolesterol ng pader ng bituka, plasma ng dugo, atay at iba pang mga organo ng parenchymal, ang pag-renew ay nangyayari sa 30 araw (1 g / araw), 50 g), dahan-dahang pagpapalitan ng kolesterol ng iba pang mga organo at tisyu, 60 g), isang napakabagal na palitan ng kolesterol ng gulugod at utak, nag-uugnay na tisyu, ang rate ng pag-update ay kinakalkula sa mga nakaraang taon. Ang synthesis ng kolesterol ay nangyayari sa cytosol ng mga cell. Ito ang isa sa pinakamahabang metabolic pathway sa katawan ng tao. Nagpapatuloy ito sa 3 yugto: ang unang nagtatapos sa pagbuo ng mevalonic acid, ang pangalawa sa pagbuo ng squalene (linear hydrocarbon istraktura na binubuo ng 30 carbon atoms). Sa ikatlong yugto, ang squalene ay na-convert sa isang molekulang lanosterol, pagkatapos ay mayroong 20 sunud-sunod na reaksyon na nagpapalitan ng lanosterol sa kolesterol. Sa ilang mga tisyu, ang hydroxyl na grupo ng kolesterol ay nagbibigay esterify upang mabuo ang mga ester. Ang reaksyon ay nabalisa ng intracellular enzyme AHAT (acylCoA: kolesterol acyltransferase). Ang reaksyon ng esterification ay nangyayari rin sa dugo sa HDL, kung saan matatagpuan ang enzyme LHAT (lecithin: kolesterol acyltransferase). Ang mga esters ng kolesterol ay ang form kung saan ito ay dinadala ng dugo o idineposito sa mga cell. Sa dugo, halos 75% ng kolesterol ang nasa anyo ng mga ester. Ang synthesis ng kolesterol ay kinokontrol sa pamamagitan ng nakakaapekto sa aktibidad at dami ng pangunahing enzyme ng proseso - 3-hydroxy-3-methylglutaryl-CoA reductase (HMG-CoA reductase). Nakamit ito sa dalawang paraan: 1. Phosphorylation / dephosphorylation ng HMG-CoA reductase. Pinasisigla ng insulin ang dephosphorylation ng HMG-CoA reductase, sa gayon ay isinalin ito sa isang aktibong estado. Samakatuwid, sa panahon ng pagsipsip, ang synthesis ng kolesterol ay nagdaragdag. Sa panahong ito, ang pagkakaroon ng panimulang substrate para sa synthesis, acetyl-CoA, ay nagdaragdag din. Ang Glucagon ay may kabaligtaran na epekto: sa pamamagitan ng protina kinase A, pinasisigla nito ang phosphorylation ng HMG-CoA reductase, na nagiging isang hindi aktibo na estado. Bilang isang resulta, ang synthesis ng kolesterol sa panahon ng postabsorption at sa panahon ng pag-aayuno ay hinarang. 2. Paglikha ng synthesis ng HMG-CoA reductase.Ang kolesterol (pagtatapos ng produkto ng metabolic pathway) ay nagbabawas ng rate ng transkripsyon ng HMG-CoA reductase gene, sa gayon pinipigilan ang sariling synthesis, at mga acid ng apdo ay nagdudulot din ng isang katulad na epekto. Ang transportasyon ng kolesterol sa dugo ay isinasagawa bilang bahagi ng gamot. Nagbibigay ang mga LP ng exogenous kolesterol sa mga tisyu, matukoy ang mga daloy nito sa pagitan ng mga organo at excretion mula sa katawan. Ang exogenous kolesterol ay naihatid sa atay bilang bahagi ng natitirang ChM. Doon, kasama ang synthesized endogenous cholesterol, bumubuo ito ng isang karaniwang pondo. Sa mga hepatocytes, ang mga TAG at kolesterol ay nakabalot sa VLDL, at sa form na ito ay nakatago sa dugo. Sa ilalim ng impluwensya ng LP-lipase, hydrolyzing TAG sa gliserol at fatty acid sa dugo, ang mga VLDLP ay unang na-convert sa mga STLP at pagkatapos ay sa mga LDLP na naglalaman ng hanggang sa 55% ng kolesterol at mga ester nito. Ang LDL ay ang pangunahing paraan ng transportasyon ng kolesterol na kung saan ito ay naihatid sa mga tisyu (70% ng kolesterol at ang mga esters nito sa dugo ay bahagi ng LDL). Ang LDL mula sa dugo ay pumapasok sa atay (hanggang sa 75%) at iba pang mga tisyu na may mga receptor ng LDL sa kanilang ibabaw. Kung ang dami ng kolesterol na pumapasok sa cell ay lumampas sa pangangailangan nito, kung gayon ang synthesis ng mga receptor ng LDL ay pinigilan, na binabawasan ang daloy ng kolesterol mula sa dugo. Sa isang pagbawas sa konsentrasyon ng libreng kolesterol sa cell, sa kabaligtaran, ang synthesis ng receptor ay isinaaktibo. Ang mga hormone ay kasangkot sa regulasyon ng synthesis ng LDL na receptor: ang insulin, triiodothyronine at mga sex sex ay nagdaragdag ng pagbuo ng mga receptor, at bumaba ang mga glucocorticoid. Sa tinaguriang "koleksyon ng pagbabalik ng kolesterol", i.e. ang landas na nagsisiguro sa pagbabalik ng kolesterol sa atay, ang HDL ay gumaganap ng pangunahing papel. Ang mga ito ay synthesized sa atay sa anyo ng mga hindi pa maaga precursors na halos hindi naglalaman ng kolesterol at TAG. Ang mga precursor ng HDL sa dugo ay saturated na may kolesterol, natatanggap ito mula sa iba pang mga LP at cell lamad. Ang paglipat ng kolesterol sa HDL ay nagsasangkot sa LHAT enzyme na matatagpuan sa kanilang ibabaw. Ang enzyme na ito ay naka-attach sa isang natitirang fatty acid mula sa phosphatidylcholine (lecithin) hanggang sa kolesterol. Bilang isang resulta, ang isang molekulang hydrophobic ng kolesterol ester ay nabuo, na gumagalaw sa loob ng HDL. Kaya, hindi lasing HDL, pinayaman ng kolesterol, naging HDL 3 - matanda at mas malaking mga particle. HDL 3 palitan ang mga esters ng kolesterol para sa TAG na nilalaman sa VLDL at STD sa pakikilahok ng isang tiyak na protina na naglilipat ng mga esters ng kolesterol sa pagitan ng lipoproteins. Sa kasong ito, HDL 3 maging HDL2, ang laki ng kung saan tataas dahil sa akumulasyon ng TAG. Ang VLDL at STDL sa ilalim ng impluwensya ng LP-lipase ay na-convert sa LDL, na pangunahing naghahatid ng kolesterol sa atay. Ang isang maliit na bahagi ng kolesterol ay naihatid sa atay ng HDL2 at HDL. Sintesis ng mga acid ng apdo. Sa atay, 500-700 mg ng mga acid ng apdo bawat araw ay synthesized mula sa kolesterol. Kasama sa kanilang pagbuo ang mga reaksyon ng pagpapakilala ng mga pangkat ng hydroxyl na may pakikilahok ng mga hydroxylases at ang reaksyon ng bahagyang oksihenasyon ng kadena ng kolesterol (Fig. 22.2): Fig. 22.2. Scheme ng pagbuo ng mga acid ng apdo. Ang unang reaksyon ng synthesis - ang pagbuo ng 7-a-hydroxycholesterol - ay regulasyon. Ang aktibidad ng enzyme na catalyzes reaksyon na ito ay hinarang ng pagtatapos ng produkto ng pathway, mga acid ng apdo. Ang isa pang mekanismo ng regulasyon ay ang phosphorylation / dephosphorylation ng enzyme (ang form ng phosphorylated na 7-a-hydroxylase) ay aktibo). Posible rin ang regulasyon sa pamamagitan ng pagpapalit ng dami ng enzyme: ang kolesterol ay nagpapahiwatig ng transkripsyon ng 7-a-hydroxylase gene, at ang reaksyon ng apdo. Ang mga hormone ng teroydeo ay nagtulak sa synthesis ng 7-a-hydroxylase, at pagsugpo sa estrogen. Ang ganitong epekto ng estrogen sa synthesis ng mga acid ng apdo ay nagpapaliwanag kung bakit nangyayari ang sakit na gallstone sa mga kababaihan ng 3-4 beses nang mas madalas kaysa sa mga kalalakihan. Cholic at chenodeoxycholic acid na nabuo mula sa kolesterol ay tinawag na "pangunahing bile acid". Ang karamihan sa mga acid na ito ay sumasailalim sa pagsasama-sama - ang pagdaragdag ng mga glycine o taurine molekula sa grupo ng carboxyl ng apdo acid. Ang pag-uumpisa ay nagsisimula sa pagbuo ng aktibong anyo ng mga acid ng apdo - mga derivatives ng CoA, kung gayon ang taurine o glycine ay nakalakip, at bilang isang resulta 4 na mga variant ng conjugates ay nabuo: taurocholic at taurohenodeoxycholic, glycocholic at glycohenodeoxycholic acid. Ang mga ito ay makabuluhang mas malakas na mga emulsifier kaysa sa orihinal na mga acid ng apdo. Ang mga salungat na may glycine ay nabuo ng 3 beses na higit pa sa taurine, dahil ang halaga ng taurine sa katawan ay limitado. Sa bituka, ang isang maliit na halaga ng mga conjugates ng pangunahing mga acid ng apdo sa ilalim ng pagkilos ng mga bacterial enzymes ay na-convert sa pangalawang mga acid ng apdo. Ang Deoxycholic acid, na nabuo mula sa cholic, at lithocholic, na nabuo mula sa deoxycholic, ay hindi gaanong natutunaw at mas mabagal na hinihigop sa mga bituka. Halos 95% ng mga acid ng apdo na pumapasok sa bituka na bumalik sa atay sa pamamagitan ng portal vein, pagkatapos ay muling na-sikreto sa apdo at muling ginamit sa emulipikasyon ng mga taba. Ang landas ng mga acid ng apdo ay tinatawag na sirkulasyon ng enterohepatic. Sa mga feces, ang pangalawang mga acid ng apdo ay kadalasang tinanggal. Ang sakit na gallstone (cholelithiasis) ay isang proseso ng pathological kung saan ang mga bato ay bumubuo sa gallbladder, ang batayan ng kung saan ay kolesterol. Ang pagpapalabas ng kolesterol sa apdo ay dapat na sinamahan ng isang proporsyonal na pagpapakawala ng mga acid ng apdo at phospholipids, na pinapanatili ang mga molekula ng hydrophobic kolesterol sa estado ng micellar. Ang mga kadahilanan na humahantong sa isang pagbabago sa ratio ng mga acid ng apdo at kolesterol sa apdo ay: pagkain na mayaman sa kolesterol, nutrisyon na may mataas na calorie, pagwawalang-kilos ng apdo sa gallbladder, may kapansanan na sirkulasyon ng enterohepatic, kapansanan synthesis ng mga acid ng apdo, impeksyon sa gallbladder. Sa karamihan ng mga pasyente na may cholelithiasis, ang synthesis ng kolesterol ay nadagdagan, at ang synthesis ng mga acid ng apdo mula dito ay pinabagal, na humantong sa isang disproporsyon sa dami ng kolesterol at mga acid ng apdo na itinago sa apdo. Bilang isang resulta, ang kolesterol ay nagsisimula na tumubo sa gallbladder, na bumubuo ng isang malapot na pag-unlad na unti-unting nagpapatigas. Minsan ito ay pinapagbinhi ng bilirubin, protina at asing-gamot na kaltsyum. Ang mga bato ay maaaring binubuo lamang ng kolesterol (mga bato ng kolesterol) o isang halo ng kolesterol, bilirubin, protina at calcium. Karaniwang puti ang mga bato ng kolesterol, at ang halo-halong mga bato ay kayumanggi sa iba't ibang lilim. Sa paunang yugto ng pagbuo ng bato, ang chenodeoxycholic acid ay maaaring magamit bilang isang gamot. Minsan sa gallbladder, unti-unting natutunaw ang mga kolesterol na bato, ngunit ito ay isang mabagal na proseso na tumatagal ng ilang buwan. Ang Atherosclerosis ay isang patolohiya na nailalarawan sa pamamagitan ng hitsura ng mga atherogenikong plaka sa panloob na ibabaw ng vascular wall. Ang isa sa mga pangunahing dahilan para sa pagbuo ng tulad ng isang patolohiya ay isang paglabag sa balanse sa pagitan ng paggamit ng kolesterol mula sa pagkain, synthesis at excretion mula sa katawan. Ang mga pasyente na may atherosclerosis ay nakataas ang mga konsentrasyon ng LDL at VLDL. Mayroong kabaligtaran na relasyon sa pagitan ng konsentrasyon ng HDL at ang posibilidad na magkaroon ng atherosclerosis. Ito ay naaayon sa konsepto ng paggana ng LDL bilang mga tagadala ng kolesterol sa mga tisyu, at HDL mula sa mga tisyu. Ang pangunahing metabolic "paunang kinakailangan" para sa pagbuo ng atherosclerosis ay hypercholesterolemia. (mataas na kolesterol sa dugo). Bumubuo ang Hypercholesterolemia: 1. dahil sa labis na paggamit ng kolesterol, karbohidrat at taba, 2. isang genetic predisposition na binubuo sa mga namamana na mga depekto sa istraktura ng mga receptor ng LDL o apoB-100, pati na rin sa nadagdagan synthesis o pagtatago ng apoB-100 (sa kaso ng pinagsama-samang hyperlipidemia, na kung saan ang konsentrasyon ng dugo at kolesterol at TAG ay nakataas). Ang isang mahalagang papel sa mga mekanismo ng pag-unlad ng atherosclerosis ay nilalaro ng pagbabago ng gamot. Ang mga pagbabago sa normal na istraktura ng lipids at protina sa LDL ay ginagawang banyaga sa katawan at sa gayon mas madaling ma-access para sa pagkuha ng mga phagocytes. Ang pagbabago ng droga ay maaaring mangyari ng maraming mekanismo: 1. glycosylation ng mga protina na nangyayari kapag tumataas ang konsentrasyon ng glucose sa dugo, 2. pagbabago ng peroxide, na humahantong sa mga pagbabago sa lipid sa lipoproteins at ang istraktura ng apoB-100, 3. ang pagbuo ng mga autoimmune complexes ng LP-antibody (binago na gamot ay maaaring maging sanhi ng pagbuo ng mga autoantibodies). Ang binagong LDL ay hinihigop ng mga macrophage. Ang prosesong ito ay hindi kinokontrol ng dami ng hinihigop ng kolesterol, tulad ng sa pagpasok nito sa mga cell sa pamamagitan ng mga tiyak na receptor, samakatuwid ang mga macrophage ay labis na na-overload ng kolesterol at nagiging "foamy cells" na tumagos sa subendothelial space. Ito ay humahantong sa pagbuo ng mga lipid spot o mga guhit sa dingding ng mga daluyan ng dugo. Sa yugtong ito, ang vascular endothelium ay maaaring mapanatili ang istraktura nito. Sa isang pagtaas ng bilang ng mga cell ng bula, nangyayari ang pagkasira ng endothelial. Ang pinsala ay nag-aambag sa pag-activate ng platelet. Bilang isang resulta, nai-secrete nila ang thromboxane, na pinasisigla ang pagsasama-sama ng platelet, at nagsisimula ring gumawa ng kadahilanan ng paglago ng platelet, na pinasisigla ang paglaganap ng mga makinis na mga cell ng kalamnan. Ang huli ay lumipat mula sa medial hanggang sa panloob na layer ng arterial wall, kaya nag-aambag sa paglaki ng plaka. Pagkatapos ang plake sprouts na may fibrous tissue, ang mga cell sa ilalim ng fibrous membrane ay necrotic, at ang kolesterol ay idineposito sa intercellular space. Sa mga huling yugto ng pag-unlad, ang plaka ay pinapagbinhi ng mga asing-gamot ng kaltsyum at nagiging napaka siksik. Sa lugar ng plaka, ang mga clots ng dugo ay madalas na bumubuo, na humaharang sa lumen ng daluyan, na humahantong sa talamak na pagkagambala sa sirkulasyon sa kaukulang tisyu ng tisyu at pagbuo ng isang atake sa puso. Ang regulasyon ng synthesis ng kolesterol - ang key enzyme (HMG-CoA reductase) ay isinasagawa sa iba't ibang paraan. Phosphorylation / dephosphorylation ng HMG reductase. Sa pamamagitan ng pagtaas ng ratio ng insulin / glucagon, ang enzyme na ito ng phosphory template at pumasa sa isang aktibong estado. Ang pagkilos ng insulin ay isinasagawa sa pamamagitan ng 2 mga enzyme. Ang HMG-CoA reductase kinase phosphatase, na lumiliko ang kinase sa isang hindi aktibo na estado ng dephosphorylated: Ang Phosphotase HMG-CoA reductase sa pamamagitan ng pag-convert nito sa isang aktibong estado ng dephosphorylated. Ang resulta ng mga reaksyon na ito ay ang pagbuo ng isang dephosphorylated na aktibong anyo ng HMG-CoA reductase. Dahil dito, sa panahon ng pagsipsip, tumataas ang kolesterol. Sa panahong ito, ang pagkakaroon ng paunang substrate para sa synthesis ng kolesterol - acetyl - Ang CoA ay nagdaragdag (bilang resulta ng pagkain ng pagkain na naglalaman ng mga karbohidrat at taba, dahil ang CoA acetyl ay nabuo sa panahon ng pagkasira ng glucose at fatty acid). Sa estado ng postabsorbent, ang glucagon sa pamamagitan ng proteingenase A ay nagpapasigla sa phosphorylation ng HMG - CoA - reductase, na nagiging isang hindi aktibo na estado. Ang pagkilos na ito ay pinahusay ng katotohanan na sa parehong oras ay pinasisigla ng glucagon ang phosphorylation at hindi aktibo ng phosphotase ng HMG-CoA reductase, sa gayon pinapanatili ang redmase ng HMG-CoA sa isang phosphorylated na hindi aktibo na estado. Bilang isang resulta, ang synthesis ng kolesterol sa panahon ng postabsorption at sa panahon ng pag-aayuno ay hinarang ng endogenous synthesis. Kung ang nilalaman ng kolesterol sa pagkain ay dinala sa 2%, kung gayon ang pagbubuo ng endogenous kolesterol ay bumaba nang matindi. Ngunit ang kumpletong pagtigil ng synthesis ng kolesterol ay hindi nangyayari. Ang antas ng pagsugpo ng biosynthesis ng kolesterol sa ilalim ng impluwensya ng kolesterol na nagmumula sa pagkain ay nag-iiba mula sa bawat tao. Ipinapahiwatig nito ang sariling katangian ng mga proseso ng pagbuo ng kolesterol. Sa pamamagitan ng pagbawas ng intensity ng synthesis ng kolesterol, posible na mabawasan ang konsentrasyon nito sa dugo. Kung ang balanse sa pagitan ng paggamit ng kolesterol na may pagkain at synthesis nito sa katawan sa isang banda at ang paglabas ng mga acid ng bile at kolesterol sa iba pa ay nasira, ang konsentrasyon ng kolesterol sa mga tisyu at pagbabago ng dugo. Ang pinaka-malubhang kahihinatnan ay nauugnay sa isang pagtaas sa konsentrasyon ng kolesterol sa dugo (hypercholesterolemia), habang ang posibilidad ng pagbuo ng atherosclerosis at cholelithiasis ay nagdaragdag. Familial hypercholesterolemia (HCS) - ang form na ito ay mas karaniwan - tungkol sa 1 pasyente bawat 200 katao. Ang isang minanang depekto sa HCS ay isang paglabag sa pagsipsip ng LDL ng mga cell, at samakatuwid, isang pagbawas sa rate ng LDL catabolism. Bilang isang resulta, ang konsentrasyon ng LDL sa dugo ay tumataas, pati na rin ang kolesterol dahil marami ito sa LDL. Samakatuwid, sa HCS, pag-aalis ng kolesterol sa mga tisyu, partikular sa balat (xanthomas), sa mga dingding ng mga arterya ay katangian. Paglikha ng synthesis ng HMG-CoA reductase Ang pangwakas na produkto ng metabolic pathway ng kolesterol. Binabawasan nito ang rate ng transkripsyon ng HMG-CoA reductase gene, kaya pinipigilan ang sariling synthesis. Ang atay ay aktibong synthesizing bile acid mula sa kolesterol, at samakatuwid ang mga acid ng apdo ay nagbabawas sa aktibidad ng HMG-CoA reductase gene. Dahil ang redmase ng HMG-CoA ay umiiral pagkatapos ng synthesis ng tungkol sa 3, ang pagsugpo sa synthesis ng enzim na kolesterol na ito ay isang mabisang regulasyon. Panoorin ang video: How Our Bodies Make Vitamin D. Corporis (Nobyembre 2024). |